Biosimilares: hacia drogas biológicas más accesibles
Los productos biológicos se encuentran entre los medicamentos más caros.
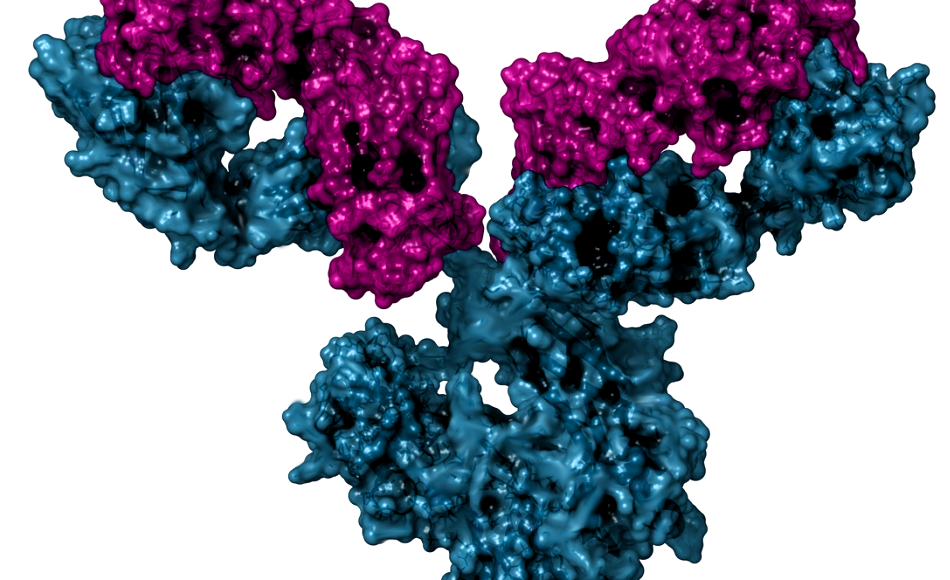 Imagen: Anticuerpo monoclonal-Biltz Krieg-Wikimedia
Imagen: Anticuerpo monoclonal-Biltz Krieg-Wikimedia
Imitaciones menos costosas de proteínas terapéuticas y anticuerpos monoclonales pueden ser igualmente efectivos.
Los medicamentos biológicos, que incluyen proteínas terapéuticas y anticuerpos monoclonales, son moléculas complejas grandes producidas por microorganismos genéticamente modificados.
Estos productos biológicos son muy efectivos en el tratamiento de enfermedades autoinmunes, cáncer, artritis reumatoide, diabetes y anemia, pero los precios, a menudo superiores a USD 100 000 por paciente por año
Los biosimilares son imitaciones menos costosas del producto de referencia. Pero son diferentes de los genéricos en que no son copias exactas.
Como resultado de su compleja composición, los productos biológicos son muy sensibles a las condiciones de fabricación y manipulación, y muchos de esos detalles de producción son propiedad intelectual altamente protegida de la empresa que desarrolla el medicamento inicial.
Cada nuevo biosimilar tiene que realizar ensayos clínicos para demostrar que el resultado coincide con el del biológico que imita a pesar de que parece estructuralmente diferente.
Al igual que los genéricos, los biosimilares pueden ayudar a reducir los costos de los medicamentos, aunque los ahorros son menores debido a su complejidad, así como a los desafíos regulatorios de obtener las aprobaciones de la FDA (Food and Drug Administration) de EE. UU. o la EMA (European Medicines Agency) de la Unión Europea, como organismos de referencia que son tomados como modelo para otras legislaciones.
Estados Unidos se ha quedado atrás de Europa en cuanto a aprobaciones y aceptación de biosimilares, y se ha señalado a los problemas legales y regulatorios, los mecanismos de contratación y la falta de familiaridad de los médicos con los biosimilares como posibles barreras para la adopción. Europa ha aprobado biosimilares durante años sin problemas de seguridad o eficacia reportados.
A medida que las patentes de productos biológicos continúen caducando y se resuelvan los litigios de patentes, las aprobaciones podrían ser más rápidas y lanzamientos al mercado de más biosimilares.
Este año, la FDA cuenta con un nuevo instrumento, la Biosimilar User Fee Act (BsUFA) aprobada por el Congreso, que proporciona información transparente sobre el desarrollo y el rendimiento de los biosimilares. De esta manera introduce una legislación que reduciría los costos para los biosimilares e incentivaría a los médicos a proporcionar estas terapias seguras y de menor costo.
En cuanto a América Latina, existe una industria creciente de biosimilares, con su propia capacidad de investigación, desarrollo, producción y comercialización.
Es por eso que las agencias de Argentina (ANMAT), Brasil (ANVISA) y México (COFEPRIS) utilizaron las pautas de la FDA, EMA y OMS como referencias para lanzar sus propias regulaciones. Amega Biotech, Biosidus, Laboratorios Elea, grupo Insud-mAbxience son algunas de las empresas argentinas que están en el mercado de los biosimilares.
